You are here
Etudes Cliniques
Vous trouverez ici des informations compréhensibles et fiables à propos des études cliniques. Cliquez sur les questions ci-dessous pour recevoir plus d'informations.
Pourquoi les études cliniques sont-elles importantes?
Participer à une étude clinique, en tant que patient ou en tant que volontaire sain, c'est contribuer au développement de la médecine et à un meilleur avenir pour les patients.
Pour de nombreux patients les médicaments et traitements existants sont inadaptés ou insuffisants. C'est pour cette raison que partout dans le monde des scientifiques effectuent des recherches sur de nouveaux médicaments et de nouveaux traitements. Cependant ceux-ci ne peuvent pas être lancés sur le marché sans passer par des études cliniques avec des volontaires sains et des patients. Ces études cliniques ont pour but de déterminer la sûreté (=sécurité), l'efficacité et les effets à long terme de ces nouveaux médicaments et nouveaux traitements. En outre, les nouveaux médicaments ou traitements sont également comparés aux médicaments et traitements existants.
Il est primordiale que suffisamment de personnes y participent afin d'arriver à des conclusions scientifiquement fondées.
Qu'est-ce la recherche clinique?
Durant le développement d'un nouveau médicament il faut prouver que ce nouveau médicament est sûr et efficace avant qu'il puisse être lancé sur le marché.
Le développement des médicaments se déroule en deux phases:
- une recherche préclinique est d'abord réalisée à l'aide d'études en laboratoire et chez des animaux
- la recherche clinique s'effectue ensuite chez les humains.
Un nouveau médicament ne sera testé chez l'humain qu'après qu'il ait été démontré que celui-ci est sûr et efficace chez les animaux.
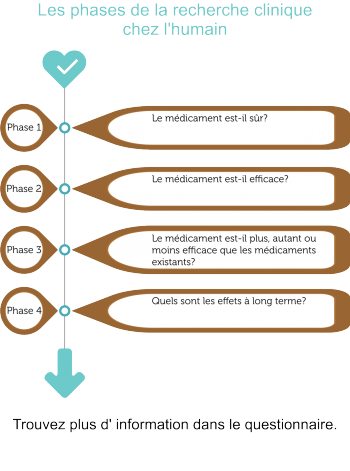
Les tests qui sont effectués chez l'humain afin de vérifier si un nouveau médicament est sûr et efficace portent le nom d'études cliniques. Ces études sont réalisées en 4 étapes ou phases consécutives (I, II, III, IV).
Quelles sont les phases de la recherche clinique chez l'humain?
- Recherche préclinique en laboratoire et chez les animaux
- Recherche clinique chez l'humain
La recherche clinique se compose d'études cliniques strictement contrôlées en 4 étapes consécutives:
- Etude phase I - Le médicament est-il sûr?
Le nouveau médicament potentiel est généralement donné à un petit groupe (20 à 100) de volontaires sains afin d'examiner les effets globaux (distribution, métabolisme et élimination, ainsi que tout événement indésirable) du nouveau médicament. - Etude phase II - Le médicament est-il efficace?
S'il est conclu sur base des résultats de l'étude phase I que le médicament est sûr, une étude de phase II sera débutée chez un petit groupe de patients sélectionnés (100 à 500) qui participent volontairement. Pendant cette phase on examine si le nouveau médicament potentiel fonctionne en tant que traitement pour la maladie pour laquelle il a été développé. Les patients qui peuvent participer seront sélectionnés sur base de critères d'inclusion et d'exclusion stricts. Ceci est fait afin de minimaliser les variations dans le groupe en matière de traitement des données. - Etude phase III - Le médicament est-il plus, autant ou moins efficace que les médicaments ou traitements existants?
Le nouveau médicament potentiel est étudié dans un groupe de patients plus large (1000 à 5000) pour analyser l'efficacité et la sûreté à long terme. Dans cette phase, le nouveau médicament est comparé à d'autres médicaments ou traitements existants pour cette maladie. Si l'on peut démontrer que le médicament a un résultat satisfaisant ou supérieur et qu'il est sûr, il sera enregistré officiellement sur le marché. A partir de ce moment-là le nouveau médicament sera disponible et il pourra être prescrit par les médecins. - Etude phase IV - Quels sont les effets à long terme?
Après l'introduction du nouveau médicament sur le marché, la sûreté sera encore suivie. Les éventuels effets secondaires qui se produisent sporadiquement et les complications à long terme seront observés durant les études phase IV. Dans certains cas il est également examiné si le médicament est efficace pour d'autres maladies.
Qui mène les études cliniques?
Il y a une distinction entre les études commerciales et les études non-commerciales ou académiques. L'initiateur d'une étude commerciale est une entreprise pharmaceutique ou une société qui développe des dispositifs médicaux. L'initiateur d'une étude académique est un médecin de recherche d'un hôpital.
Les deux types d'études doivent respecter les mêmes règles strictes; dans les deux cas le volontaire est aussi bien protégé et a les mêmes droits et obligations.
Lors des études commerciales il n'y a pas de contact direct entre le patient et l'initiateur. Tous les contacts se font par un médecin de recherche et son personnel de recherche qui sont liés à l'étude. Le médecin de recherche est responsable de la supervision, le contrôle et l'examen des volontaires.
Qui peut participer à une étude clinique?
Aussi bien des volontaires sains ainsi que des patients malades peuvent être impliqués dans une étude clinique.
Afin d'être accepté à participer il faut répondre aux caractéristiques et conditions spécifiques qui sont décrites dans le protocole de l'étude. Le protocole d'une étude clinique contient toutes les règles et les procédures de l'étude. C'est en quelque sorte le scénario à suivre pour l'effectuer correctement. Le protocole doit toujours recevoir l'approbation du comité d'éthique et de l'autorité publique avant que l'étude puisse commencer.
Les conditions de participation sont aussi appelées les critères d'inclusion et d'exclusion.
Les participants potentiels:
- seront et devront être informés en détail de l'étude sur base du formulaire d'information;
- devront comprendre ce que signifie la participation, y compris les risques et les avantages possibles;
- devront uniquement participer de manière volontaire comme mentionné dans le formulaire de consentement;
- devront être assurés pour des dommages éventuels;
- devront pouvoir arrêter la participation à tout moment;
- devront donner leurs consentement et soussigner un document, appelé le formulaire de consentement éclairé, avant le début de l'étude.
Est-ce sûr de participer à une étude clinique et qui peut garantir cette sûreté/sécurité?
Les études cliniques sont très strictement réglementées afin de réduire le risque au minimum pour les patients et les volontaires sains. Pour protéger les droits, l'intégrité et la confidentialité des volontaires et la crédibilité des données de l'étude, des conditions éthiques et scientifiques internationales ont été définies dans la Déclaration d'Helsinki et l'orientation de bonnes pratiques cliniques (Good Clinical Practice, GCP).
Avant de commencer une étude, l'approbation d'un comité d'éthique accrédité et l'approbation de l'autorité compétente (en Belgique il s'agit de l'Agence Fédérale des Médicaments et Produits de Santé, l'AFMPS) doivent être obtenus. Les deux institutions mentionnées expriment une opinion et évaluent si le produit est sûr et si les bénéfices du nouveau médicament ou du nouveau traitement compensent les risques potentiels associés à l'étude. Seulement après avoir obtenu un avis favorable (= approbation) l'étude peut commencer.
Pendant toute la durée de l'étude le comité d'éthique protège l'intérêt des participants. A tout moment la décision d'arrêter l'étude peut être prise, par exemple à la suite d'effets secondaires inacceptables.
Quels sont les risques potentiels de participer à une étude clinique?
Tout d'abord un protocole d'étude est concu pour créer une étude clinique. Le protocole doit toujours recevoir l'approbation du comité d'éthique et de l'autorité avant que l'étude puisse commencer. Et pendant toute la durée de l'étude, le comité d'éthique continue à protéger l'intérêt des participants. Néanmoins, il peut y avoir des risques ou des inconvénients associés à la participation à une étude clinique. Le profil de risque d'une étude est analysé à l'avance par différentes parties (l'initiateur, les médecins, les comités d'éthiques et l'autorité) et l'étude ne peut commencer que si la balance bénéfices/risques penche en faveur des bénéfices.
Lorsqu'on parle des risques/inconvénients, de quoi s'agit-il:
- Le médicament ou le traitement est généralement nouveau et encore sous investigation. Cela signifie souvent que les effets indésirables et/ou les effets secondaires ne sont pas encore tous connus. Le risque d'effets indésirables et secondaires inconnus est différent pour chaque étude et n'est pas totalement prévisible. Par conséquent, le médecin de recherche donnera plus d'informations au volontaire à ce sujet avant le début de l'étude. Les effets indésirables et secondaires sont naturellement suivis de près à la fois par le médecin de recherche et par les comités d'éthiques qui veillent à la sécurité de tous les participants. En outre, un participant peut également décider à tout moment de mettre fin à sa participation à l'étude.
- Il est possible que le nouveau médicament ou traitement n'ait pas de valeur ajoutée.
- En général, le participant à une étude phase II ou phase III ne sait pas s'il reçoit le nouveau médicament ou pas. Suivant les directives éthiques, le protocole d'étude peut prévoir un groupe de contrôle qui ne reçoit aucun médicament actif mais un placebo.
- La participation peut exiger un effort supplémentaire du participant, comme des visites supplémentaires à l'hôpital et/ou des tests ou procédures supplémentaires (par exemple des tests sanguins supplémentaires).
Questions au sujet de votre participation possible
Envisagez-vous de vous inscrire comme candidat(e) pour une étude clinique? Cliquez sur les questions ci-dessous concernant votre participation possible.
Pourquoi participer et quels sont les bénéfices potentiels de votre participation à une étude clinique?
- En participant à une étude clinique vous soutenez la recherche médicale et vous aidez également à contribuer au développement de la médecine.
- En participant en tant que patient vous pouvez profiter des derniers soins de santé et d'un nouveau traitement potentiel pour votre maladie dont l'efficacité et la sécurité seront étudiées.
- Les résultats des études peuvent aider des patients futurs grâce au fait que vous contribuez au développement d'un nouveau médicament, une nouvelle thérapie, un nouveau vaccin, un meilleur test diagnostic,...
- Il est possible que le médecin de recherche fasse plus de tests qu'il ne l'aurait normalement fait afin de surveiller aussi bien que possible les effets du traitement administré. Ces traitements et/ou tests supplémentaires pendant l'étude seront gratuit.
- Les études sont strictement confidentielles et votre vie privée est protégée à tout moment.
Néanmoins, il n'y a aucune garantie que votre participation à l'étude vous apporte un bénéfice personnel. Vous devez également tenir compte qu'une étude peut comporter un effort supplémentaire et des risques potentiels. Les bénéfices possibles, mais aussi les inconvénients et les risques potentiels de l'étude seront expliqués en détail à l'avance par votre médecin de recherche. Contactez votre médecin de recherche si vous avez des questions ou si vous voulez en discuter.
Qui décide si vous pouvez participer à une étude clinique?
Le médecin de recherche décide si vous pouvez participer à une étude clinique.
Participer à une étude clinique est toujours entièrement libre et sans aucun engagement. Si vous décidez de ne pas participer à une étude cela n'influencera en aucun cas votre traitement ultérieur ni votre relation avec votre médecin. Vous pouvez également, à tout moment, décider de mettre fin à votre participation à l'étude.
Pour plus d'information concernant la procédure d'envoi vers un médecin de recherche nous vous invitons à lire la politique d'envoi vers un centre de recherche.
Comment vos données sont-elles traitées lors d'une étude clinique?
Si vous répondez aux critères de sélection d'une étude clinique et si vous décidez de participer à l'étude, votre participation et toutes vos données personnelles et médicales sont traitées confidentiellement et conformément aux lois de votre pays. Vos données sont collectées et traitées de manière codée au cours de l'étude. Ces données sont seulement traitées et analysées dans le contexte scientifique associée à l'étude. Dans les publications scientifiques des résultats de l'étude, aucune information ne pourra dévoiler l'identité des participants.
Votre médecin de recherche ne partagera à aucun moment des données médicales, qui sont collectées au cours d'une étude clinique, avec C-Lys. C-Lys est seulement impliqué dans la pré-sélection des candidats volontaires.
Qu'arrive-t-il si vous subissez des dommages lors d'une étude?
Chaque étude clinique est soigneusement conçue pour réduire le risque au minimum. Néanmoins, des problèmes imprévus ne sont jamais exclus. Par conséquent, la loi oblige l'initiateur de l'étude de prendre une assurance pour chaque étude clinique afin de protéger les participants. C-Lys est seulement impliqué dans la pré-sélection des candidats volontaires et n'est pas responsable de votre participation à une étude. Pour plus d'informations concernant l'assurance, veuillez contacter votre médecin de recherche.
Si vous êtes intéressé(e) de participer à une étude clinique, votre médecin de recherche vous expliquera le but de l'étude et les bénéfices dont vous pouvez profiter. Votre médecin vous précisera également que ces bénéfices ne peuvent pas être garantis et qu'il y a toujours des effets secondaires indésirables qui peuvent se produire à cause de la phase expérimentale du nouveau médicament ou traitement.
Recevez-vous une compensation financière pour votre participation à une étude clinique?
Quand vous participez en tant que volontaire sain à une étude phase I, une compensation financière est généralement calculée sur base des charges des examens (nombre d'échantillons de sang, le nombre de nuits à l'hôpital...) que vous subissez pour l'étude. Quand vous participez en tant que patient à une étude phase II, III ou IV, la loi n'autorise généralement pas que vous receviez une compensation financière. Dans certains cas vous pouvez avoir droit à un remboursement de vos frais de parking et de déplacement. Dans les deux cas votre médecin de recherche pourra vous donner plus d'explications à ce sujet.
La compensation financière et le remboursement des frais sont pris en charge par l'initiateur de l'étude. Etant donné que C-Lys est uniquement impliqué dans la présélection des candidats pour les études, C-Lys n'est en aucun cas responsable pour le paiement d'une indemnité aux volontaires.
Où devez-vous signaler des effets secondaires?
Quand l’on participe à une étude clinique, il est extrêmement important de signaler tout effet indésirable ou des effets secondaires au médecin traitant. Cela aide à vérifier la sécurité du médicament ou du traitement.
Ce site C-Lys n’est pas destiné à signaler des effets secondaires possibles. Afin de protéger les participants des études cliniques des réglementations strictes sont applicables. Suite à cette situation juridique unique les employés de C-Lys ne peuvent et ne savent pas répondre aux questions concernant les produits médicaux, les traitements médicaux, les effets secondaires, ou les études cliniques spécifiques. Nous possédons seulement l'information que vous pouvez trouver sur ce site. L’information concernant les études cliniques spécifiques a été établie en consultation avec les chercheurs et a été approuvée par un comité d'éthique compétent.
Ce site C-Lys n'est pas destine à partager votre expérience dans une étude clinique. Il peut être tentant de parler avec d'autres qui, tout comme vous, participent à une étude clinique en particulier (vous pourriez parler au sujet des effets secondaires possibles ou de votre experience), mais il est important de ne pas le faire. Car ceci pourrait influencer l’issue de l’étude. Il existe en fait quelque chose comme le pouvoir de la suggestion; entendre parler d'un effet secondaire peut être suffisant pour provoquer cet effet.